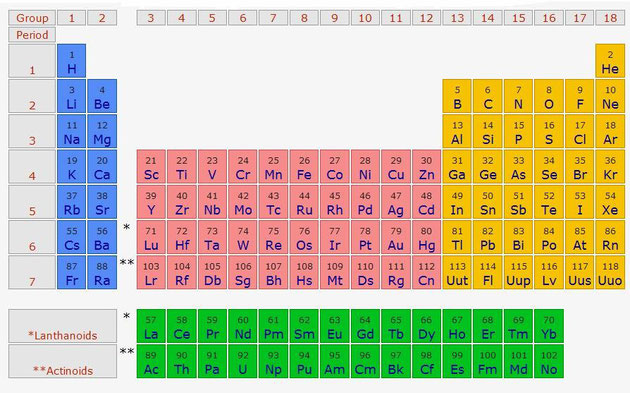
LA TABLA PERIÓDICA
GRUPOS Y PERIODOS
Los elementos químicos se ordenan en la tabla periódica en orden creciente de número atómico, de izquierda a derecha y de arriba a abajo.
La tabla periódica se organiza en:
- Filas horizontales, que se llaman periodos, que se numeran del 1 al 7 y en
- Columnas verticales que reciben el nombre de grupos, que se numeran del 1 al 18,
- Además, por facilidad de representación, aparecen dos filas horizontales fuera de la tabla que corresponden a elementos que deberían ir en el sexto y séptimo periodo, tras el segundo elemento del periodo.
LOS GRUPOS PRINCIPALES

- Los grupos con mayor número de elementos, los grupos 1, 2, 13, 14, 15, 16, 17 y 18, se conocen como grupos principales,
- Los grupos del 3 al 12 están formados por los llamados elementos de transición
- Los elementos que aparecen aparte se conocen como elementos de transición interna.
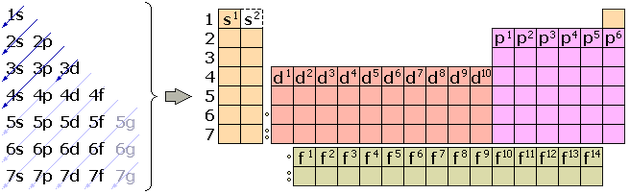
LOS GRUPOS DE LA TABLA PERIÓDICA Y LA DISTRIBUCIÓN ELECTRÓNICA
La tabla periódica puede utilizarse como guía para las configuraciones electrónicas
EJERCICIOS:
- Dada la siguiente configuración electrónica:

¿A qué elemento químico corresponde?
- Si el último término de una distribución electrónica es 4p3, ¿Cuál es su número atómico?
- Si el último término de una distribución electrónica es 3d2 ¿Cuál es su número atómico?
- Si el último término de una distribución electrónica es 5s2 ¿Cuál es su número atómico?
- ¿Cuántos electrones giran en el último nivel de un átomo de Cl? ¿Y de Ca? ¿Y del Pt?
- ¿Qué tienen en común los átomos de los elementos químicos que pertenecen al mismo grupo? ¿Y si pertenecen al mismo periodo?
UTILIDAD DE LA TABLA PERIÓDICA
La utilidad de la Tabla Periódica reside en que dicha ordenación de los elementos químicos permite poner de manifiesto muchas regularidades y semejanzas en sus
propiedades y comportamientos.
Algunas de estas regularidades más importantes son:
- Todos los elementos de un mismo grupo poseen un comportamiento químico similar, debido a que poseen el mismo número de electrones en su capa más externa (estos electrones son los que normalmente intervienen en las reacciones químicas).
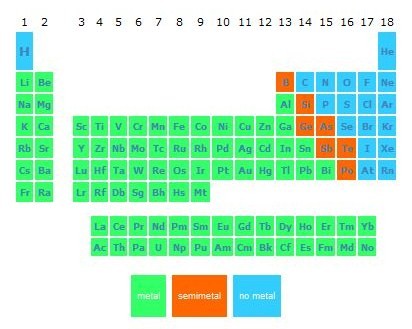
- Podemos distinguir 4 conjuntos de elementos químicos, según la facilidad de sus átomos para perder o ganar electrones, transformándose en iones:
- Metales: Se transforman fácilmente en iones positivos. Quedan situados a la izquierda y el centro de la tabla. Tienen propiedades comunes,
como conducir la electricidad y el brillo metálico. En su mayoría son sólidos a temperatura ambiente.
- Semimetales: Se transforman con dificultad en iones positivos. Tienen propiedades intermedias entre los metales y los no metales (B, Si, Ge,
As, Sb, Te, Po)
- No metales: Se transforman fácilmente en iones negativos. Se sitúan en el lado derecho. Suelen ser líquidos o gases a temperatura ambiente,
y son malos conductores de la electricidad.
- Inertes (Gases nobles -He, Ne, Ar,...): No forman iones. En condiciones normales, no se combinan con ningún otro elemento químico.
Elementos en la columna más a la derecha.
 ACT
ACT



