LOS MODELOS ATÓMICOS
El Modelo de Dalton (1800)
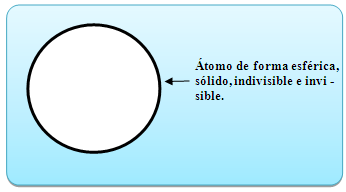
TEORÍA ATÓMICA DE DALTON:
-
Los elementos químicos están formados por átomos.
-
Estos átomos son indivisibles e indestructibles.
-
Los átomos no cambian al unirse o combinarse, es decir, cada átomo conserva sus pro piedades físicas y químicas a través de los cambios.
-
Los átomos de un mismo elemento químico son iguales en sus propiedades y peso.

LO QUE DALTON NO PUDO EXPLICAR:
La naturaleza eléctrica de la materia. Los antiguos griegos, hacia el año 600 a. C., ya sabían que al frotar ámbar con una piel, este adquiría la propiedad de atraer a cuerpos ligeros.
El Modelo de Thomson y el descubrimiento de los electrones (1904)
Thomson demostró que dentro de los átomos hay unas partículas diminutas con carga eléctrica negativa, a los que llamó electrones.
Sigue el vínculo para ver cómo los descubrió:
http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/
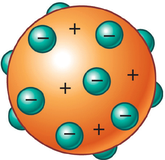
De este descubrimiento dedujo que el átomo debía de ser una esfera de materia maciza cargada positivamente, en cuyo interior estaban incrustados los electrones (modelo de "puding de pasas").
Todos lo hemos probado alguna vez, después de frotar con un paño un bolígrafo, éste atrae pequeños trozos de papel:
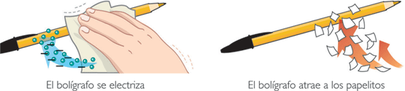
Tanto el bolígrafo como los trozos de papel han quedado electrizados: el bolígrafo por frotamiento y el papel por inducción. Al frotar el bolígrafo, éste ha adquirido una carga eléctrica negativa (los electrones pasan del paño al bolígrafo), mientras que el papel ha quedado cargado positivamente al acercarle el bolígrafo.
LO QUE THOMSON NO PUDO EXPLICAR: El experimento de Rutherford
Ernest Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas alfa (núcleos de helio) procedentes de un elemento radiactivo. Observaban, mediante una pantalla fluorescente, en qué medida eran dispersadas las partículas. La mayoría de ellas atravesaba la lámina metálica sin cambiar de dirección; sin embargo, unas pocas eran reflejadas hacia atrás con ángulos pequeños. Éste era un resultado completamente inesperado, incompatible con el modelo de atómo macizo existente.
A continuación vamos a simular el experimento de Rutherford:
- Pulsa primero el botón rojo para colocar el emisor radioactivo de partículas alfa.
- Luego coloca el bloque de plomo que cubrirá el emisor.
- Coloca la pantalla de detección de las partículas alfa.
- Coloca la lámina delgada de oro que actuará de blanco de las partículas alfa
- Play..
Si pulsas sobre la lámina de oro verás un esquema amplificado de las trayectorias de las partículas alfa al atravesar o ser desviadas por los núcleos de los átomos del metal observando que la mayoría de ellas lo atraviesan sin desviarse, agunas experimentan grandes desviaciones y otras pocas rebotan como si chocasen con algo extraordinariamente pesado.
Según el modelo de Thomson, la mayoría de las partículas se debían desviar, aunque en ningun caso mucho, no existían fuerzas suficientemente fuertes para hacerlo
El Modelo de Rutherford (1911)

El átomo está formado por dos partes: núcleo y corteza.
El núcleo es la parte central, de tamaño muy pequeño, donde se encuentra toda la carga positiva y, prácticamente, toda la masa del átomo. Esta carga
positiva del núcleo, en la experiencia de la lámina de oro, es la responsable de la desviación de las partículas alfa (también con carga positiva).
La corteza es casi un espacio vacío, inmenso en relación con las dimensiones del núcleo. Eso explica que la mayor parte de las partículas alfa atraviesan
la lámina de oro sin desviarse. Aquí se encuentran los electrones con masa muy pequeña y carga negativa.
Como en un diminuto sistema solar, los electrones giran alrededor del núcleo, igual que los planetas alrededor del Sol. Los electrones están ligados al núcleo por la atracción eléctrica entre cargas de signo contrario.
Lo que Rutherford no pudo explicar:
El modelo de átomo planetario propuesto por Rutherford mostró pronto algunos inconvenientes teóricos que lo hacían inviable. Sigue el vínculo para obtener más información...
http://web.educastur.princast.es/proyectos/fisquiweb/atomo/Crisis_B.htm
El Modelo de Borh (1913)
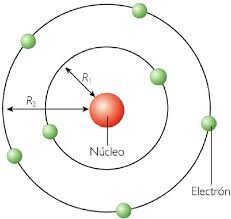
Bohr establece que los electrones solo pueden girar en ciertas órbitas de radios determinados, llamados niveles energéticos (K, L, M, N, etc...)
El descubrimiento de los protones (1932)
Por otro lado, mediante diversos experimentos se comprobó que la masa de protones y electrones no coincidía con la masa total del átomo. Rutherford ya supuso que tenía que haber otro tipo de partícula subatómica en el nucleo de los átomos. Estas partículas fueron descubiertas en 1932 por el físico J. Chadwick. Al no tener carga eléctrica fueron difíciles de descubrir y se denominaron neutrones
Modelo actual
Actualmente se ha abandonado el concepto de órbita estacionaria, debido a que no se puede determinar con exactitud la posición de un electrón en un determinado instante.
Por este motivo, han seguido apareciendo diferentes modelos que van acumulando más conceptos al modelo atómico actual, que podemos definir como la suma de todos los anteriores.
El concepto de órbita estacionaria se ha sustituído por el de nube de electrones y las zonas donde es más probable encontrar a un electrón se denomina orbital.
El modelo de Borh, sin embargo, es muy útil y es el que vamos a utilizar para conocer la estructura del átomo, incluyendo los neutrones en el núcleo.
TAREA 1
- Un dibujo de cada modelo.
- Una explicación del modelo.
- Lo que cada modelo no explicó y dio origen al siguiente modelo.
 ACT
ACT



