LA CORTEZA ATÓMICA
¿Cómo se distribuyen los electrones en los niveles energéticos?
Los electrones que giran alrededor del núcleo de cualquier átomo no están dispuestos aleatoriamente. Éstos giran alrededor del núcleo en niveles energéticos u orbitales.
Los electrones solamente pueden ocupar ciertos niveles energéticos u orbitales definidos. No pueden existir entre ellos. La posición de los electrones y, en concreto, el número de electrones de cada nivel energético afecta a la forma de comportarse de las sustancias.
Los electrones siempre llenan primero los niveles energéticos más bajos disponibles, de modo que los orbitales interiores siempre se llenan antes que los exteriores. Los niveles energéticos de los electrones sólo pueden contener un número determinado de electrones.
|
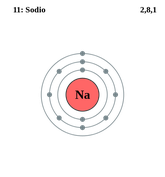
· El primer nivel energético sólo puede contener 2 electrones. Los electrones siempre llenan primero este nivel. Cuando este nivel está lleno, los electrones pasan al segundo nivel.
· El segundo nivel energético puede contener hasta 8 electrones. Los electrones del segundo nivel tienen más energía que los del primero.
· El tercer nivel energético puede contener hasta 18 electrones. Sin embargo, cuando hay ocho electrones en este nivel energético, el átomo se vuelve más estable y los electrones restantes tienden a pasar al siguiente nivel energético. |
Sigue el enlace:
https://www.wikisaber.es/Contenidos/LObjects/02_electron_arrangement_in_an_atom/index.html
Dibuja los siguientes átomos en tu cuaderno e indica cuántos electrones tiene cada uno en el último nivel:
Na (Z=11); Al (Z=13); Si (Z=14); Cl (Z=17) y Ne (Z=10)
CONFIGURACIÓN ELECTRÓNICA
ANTES DE NADA SIGUE ESTE ENLACE: PUEDE PARECER CONFUSO, PERO...
REGLAS PARA DEDUCIR LA CONFIGURACIÓN ELECTRÓNICA:
- Los niveles se indican mediante números naturales empezando por el 1: 1, 2, 3, 4, 5, 6, 7, 8
- Los subniveles se indican mediante las letras s, p, d y f.
- Los tres primeros niveles no tienen todos los subniveles:
-
- El nivel 1 solo tiene subnivel s
- El nivel 2 solo tiene s y p
- El nivel 3 solo tiene s, p y d
- Cada subnivel solo admite un número máximo de electrones:
-
- Subnivel s -> 2 e
- Subnivel p -> 6 e
- Subnivel d -> 10 e
- Subnivel d -> 14 e
- Un determinado subnivel de un nivel no puede empezar a llenarse de electrones si los anteriores no están llenos.
ORDEN DE LLENADO
El orden de llenado lógico debería ser de tal manera que primero se llena todo el primer nivel, luego todo el segundo, luego todo el tercero, etc. Y dentro de cada nivel, según el orden s – p – d – f, es decir:
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f …
Sin embargo, a partir del 3p el orden de llenado de la corteza electrónica empieza a variar. Para deducir el orden correcto, es necesario recurrir al diagrama de Moeller:
PARA EJERCITARSE...
Escribe las configuraciones electrónicas de los átomos de los siguientes elementos químicos (deberás consultar sus números atómicos en la tabla periódica):
Ca, F, Ne, Ag, P, y Al
Si quieres ver en qué orden se llenan los orbitales, sigue el enlace y a continuación realiza las actividades propuestas en tu cuaderno:


 ACT
ACT



